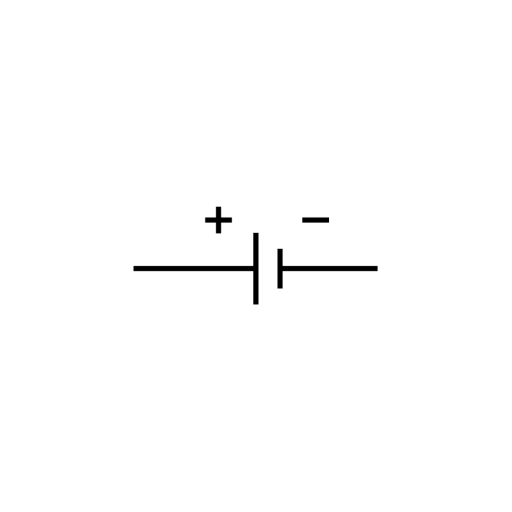电化电池
电化电池
电化电池(electrochemical cell)又称电化学电池、化学电池,是一种能够从化学反应中“产生电能”或“利用电能引起化学反应”的装置。
按此定义,分为两种类型:
-
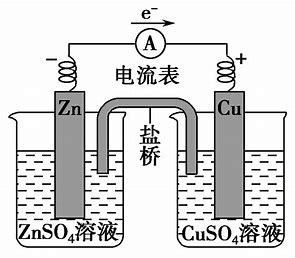
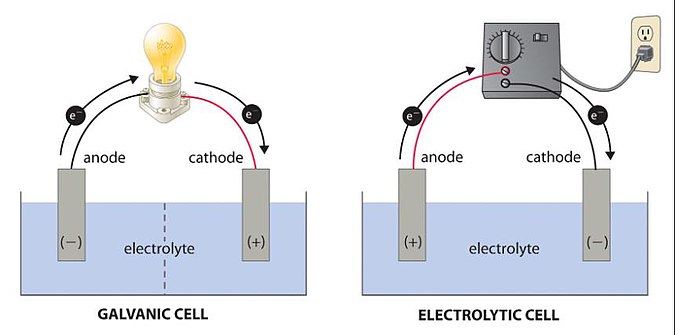
原电池(primary cell)包含伏打电池(voltaic cell)、伽伐尼电池(galvanic cell),是产生电能与电流的电化学电池,即发生化学反应(氧化还原反应)将化学能转为电能的装置。
-
电解池(electrolytic cell)又称电解电池,是利用电能且通过电解等方式产生化学反应的电化学电池,即输入电能引发化学反应的装置。
近似的术语“电池组”(electric battery)则是指由一个或多个电池组成,以并联、串联或串并联方式连接;也简称“电池”。
组成
-
原电池
-
负极(-):发生氧化反应(放出电子)的电极,进行的反应称为氧化半反应。
-
正极(+):发生还原反应(接受电子)的电极,进行的反应称为还原半反应。
-
-
电解池
-
阳级(+):发生氧化反应(放出电子)的电极,进行的反应称为氧化半反应。
-
阴极(-):发生还原反应(接受电子)的电极,进行的反应称为还原半反应。
-
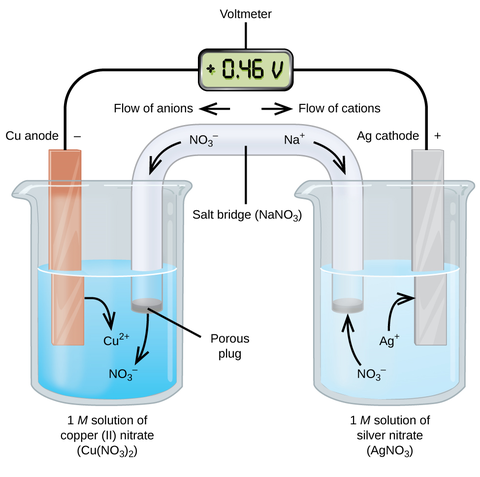
两个半电池可结合成一个电池。
- 盐桥:提供离子通路,防止任何一个半电池中有净电荷的积存,以保持溶液的电中性。
表示法
-
阳极在左,阴极在右。
-
盐桥以两条直线表示,两边各为阳极及阴极之电解质。
浓度电池
-
构造:电池的两极及电解液均相同,只有电解液的浓度不同。
-
阳极:低浓度电极,产生氧化反应。
-
阴极:高浓度电极,产生还原反应。
-
-
在浓度电池中,阳极浓度(C1)对阴极浓度(C2)比值越小,则电池的电位越大。
双电池
-
两电池顺向连接:即一电池之阳极与另一电池之阴极相连接。双电池之总电压为两电池电压之和。
-
两电池逆向连接:即一电池之阳极与另一电池之阳极相连接,阴极与阴极相连接。双电池之总电压为两电池电压之差。